Information
deutsch / english
Diagramm-Beispiele / diagram examples
VLE
Phasengleichgewichte
Dampf-Flüssigkeit (-Flüssigkeit) und Mischungsfunktionen
Phasendiagramme, Versuchsauswertung,
Flash-Berechnungen
VLE ist neben seiner Funktion
als Lehrprogramm auch ein leistungsfähiges Werkzeug zur Modellierung von
Phasengleichgewichten.
Leistungen von VLE:
·
Phasengleichgewichtsberechnungen
nach dem Raoult-Konzept mit
Aktivitätskoeffizienten-Modellen oder nach dem Fugazitätskonzept
mit thermischen Zustandsgleichungen
·
Flash-Berechnungen
für Gemische mit bis zu 10 Komponenten
·
komfortable
Diagrammgrafik für binäre Gemische
·
Parameter-Fitting
von Aktivitätskoeffizienten-Modellen an experimentelle V-L-Phasengleichgewichts-Daten
·
k(ij)-Wechselwirkungsparameter-Fitting an experimentelle
V-L-Phasengleichgewichts-Daten für Fugazitätskonzept
·
thermodynamische
Analyse experimenteller Datensätze
·
Vorausberechnung
von VLE realer Mischungen mit UNIFAC
·
Berechnung von
Mischungslücken binärer Systeme
·
Berechnung von Gemisch-Verdampfungsenthalpien
·
Destillationsberechnungen
(Thiele/McCabe-Trennstufen-Konstruktion
für binäre Gemische und Mehrkomponenten-Batchdestillation)
·
thermodynamische
Beurteilung von Selektivlösungsmitteln für eine Extraktivdestillation
·
Berechnung und
grafische Darstellung thermodynamischer Funktionen von Gemischen
·
integriertes
HTML-Hilfesystem, das die Programmbedienung und die theoretischen Grundlagen
erklärt; ab Version 7 eine Art "Lehrbuch anhand von Beispielen"
Alle notwendigen Reinstoffdaten werden
nach der Stoffwahl aus der angeschlossenen Datenbank *.Z06/*.Z07
entnommen und sind in einem Editor einseh- und änderbar.
Mit
Hilfe einer Sammlung von 45 Projekten (*.VL7) mit enthaltenen experimentellen
Literaturdaten von Dampf-Flüssigkeits-Gleichgewichten binärer Systeme können
Übungen zur Leistungsfähigkeit von Modellen, zum Fitting und zum Konsistenztest
durchgeführt werden. 16 dieser Projekte betreffen Systeme mit einer
überkritischen Komponente und ermöglichen Übungen zur Anwendung des Fugazitätskonzepts unter Verwendung kubischer
Zustandsgleichungen.
Die Ergebnisse werden
wahlweise als berechnete Einzelwerte oder in grafischer 2D-Darstellung
ausgegeben. Es werden ca. 30
verschiedene Funktions-Diagramme mit komfortablen Gestaltungsmöglichkeiten
angeboten.
Die deutsche Version
enthält eine kontext-sensitive HTML-Hilfe.
|
Für die freie
Studentenversion gelten einige Einschränkungen: ·
begrenzt auf die 55 Stoffe der Mini-Datenbank
student.Z07 bzw. student.Z06 (Vollversion 4450 Stoffe); ·
eingeschränkte UNIFAC-Parameter-Dateien
(z. B. ohne Parameter für Kältemittel und ionische Flüssigkeiten); ·
keine freie Eingabe von Stoffnamen, stattdessen
Auswahl aus der Stoffliste; ·
keine Berechnung der höheren Ableitungen der
Freien Mischungsenthalpie (bis sechste); ·
eingeschränkte Mischungsregeln beim Fugazitäts-Berechnungskonzept (in der Vollversion
GE-Mischungsregeln); ·
kein Fitting von Wechselwirkungsparametern für
das Fugazitäts-Berechnungskonzept an experimentelle
Daten; ·
nur Sichten, kein Editieren der
Reinstoff-Datenbank; ·
Einschränkungen beim Fitting von GE-Parametern an
experimentelle Daten: o
keine T-abhängigen Parameter, o
nur
T-p-x(L)-Fitting (kein T-p-x(L)-x(V)- und T-x(L)-x(V)-Fitting). ·
„instationäre Batchdestillation“ nur in der Vollversion verfügbar Preis der Vollversion auf
Anfrage |
Vapour-Liquid
(-Liquid) Phase Equilibria and Mixing Functions
phase
diagrams, evaluation of experimental data, flash calculation
VLE is both an educational program for students and a useful tool for the
modelling of phase equilibria.
Special
features of VLE
are
·
calculation of phase
equilibria using either RAOULT’s gamma concept (with activity coefficients) or
the phi concept (with fugacity coefficients from equations of state (EOS));
·
generation of
isothermal, isobaric and isosteric phase diagrams;
·
in connection with
the linked Merseburg Database, the integrated UNIFAC concept
concept enables the user to calculate real
VLE phase equilibria and, if necessary, VLLE;
·
flash calculations
for mixtures of up to 10 components;
·
fitting of
parameters for gamma and phi models;
·
thermodynamic
analysis of experimental T-p-x data
sets (“Consistency Test”)
·
calculation of
distillations: McCABE/THIELE method for binary mixtures and batch distillation for multi-component
mixtures;
·
calculation of
miscibility gaps of binary systems;
·
calculation and graphic
display of thermodynamic functions of mixtures, (e.g. activity coefficients,
enthalpy of mixing, entropy of mixing);
·
MS Excel compatible
A collection of
T-p-x data-sets from the relevant
literature on vapour-liquid equilibria of binary systems enables “Model
Fitting” or “Consistency Test” exercises and can demonstrate the efficiency of
the UNIFAC model.
The output of the results is possible either in tables
or as 2D diagrams. There are about 30 different types of diagrams available,
each of them equipped with comfortable design possibilities.
Beispiele für Grafiken, die mittels VLE erzeugt wurden
Examples for graphs generated by means of VLE
|
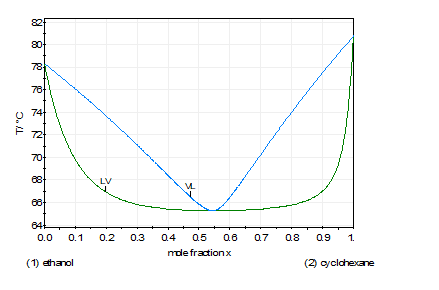
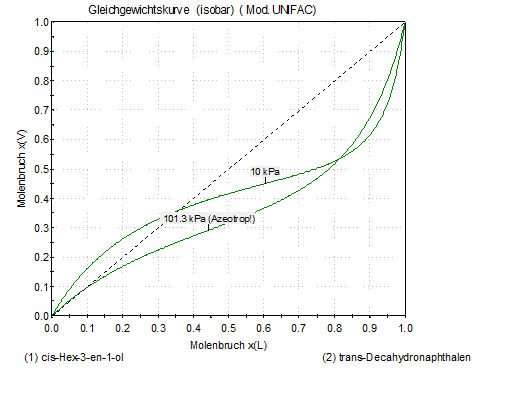
Isobares Phasendiagramm V-L mit azeotropem Punkt bei Normaldruck Isobaric V-L phase
diagram with azeotropic point at normal pressure
|
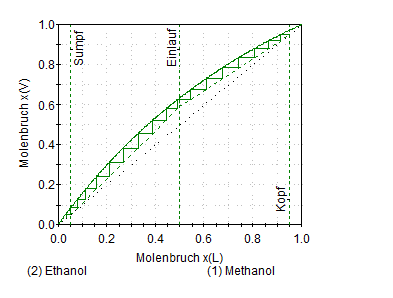
Theor. Trennstufen einer
kontinuierlichen Destillation Theoretical
plates of a continuous distillation
|
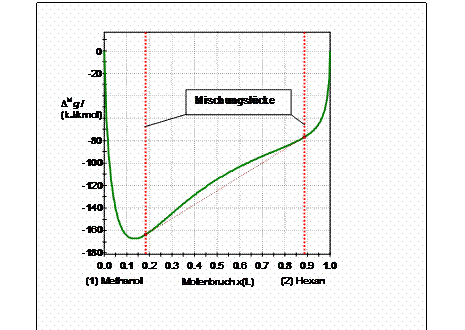
Freie Mischungsenthalpie
eines Systems mit einer Mischungslücke
System mit überkritischer Komponente
Gibbs
energy of mixung of a system with a mixing gap
System with a supercritical component
|
|
|
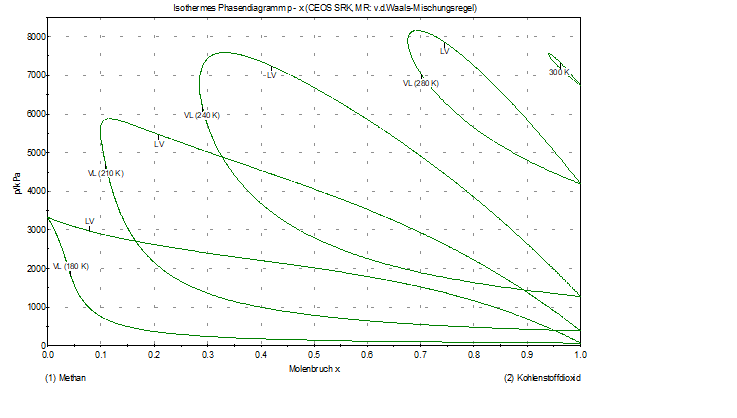
Isothermen CH4-CO2 im überkritischen
Bereich von Methan (210 … 300) K
Isothermals CH4-CO2 in the supercritical range of methane (210 … 300) K
Heteroazeotropes System
Heteroazeotropic
system
|
|
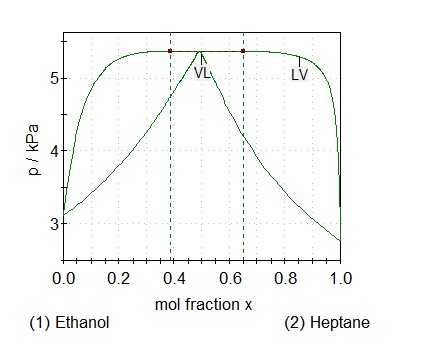
Abhängigkeit eines azeotropen Punktes vom Druck
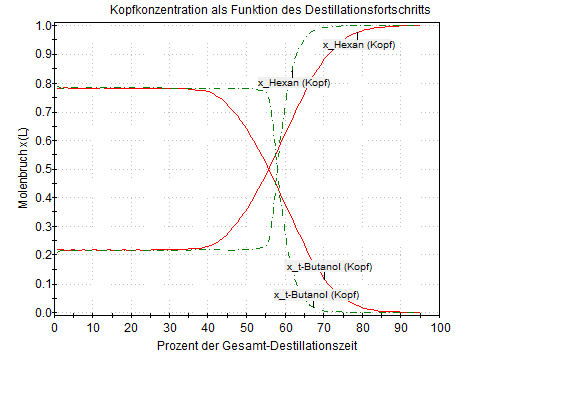
Diskontinuierliche Destillation, zwei verschiedene Rücklaufverhältnisse
Dependence of an azeotropic point on pressure
Batch distillation, two different reflux ratios
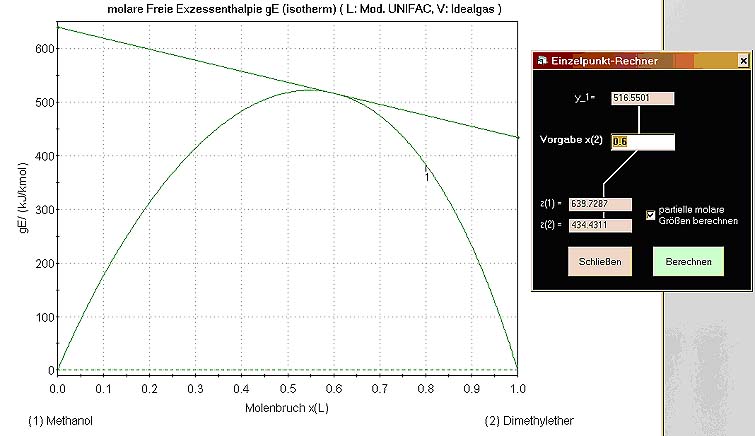
Demonstration der grafischen
Bestimmung partieller molarer Größen
(Achsenabschnitts-Methode) => Grafik-Button „calc“
Graphic
estimation of partial molal properties
|
|
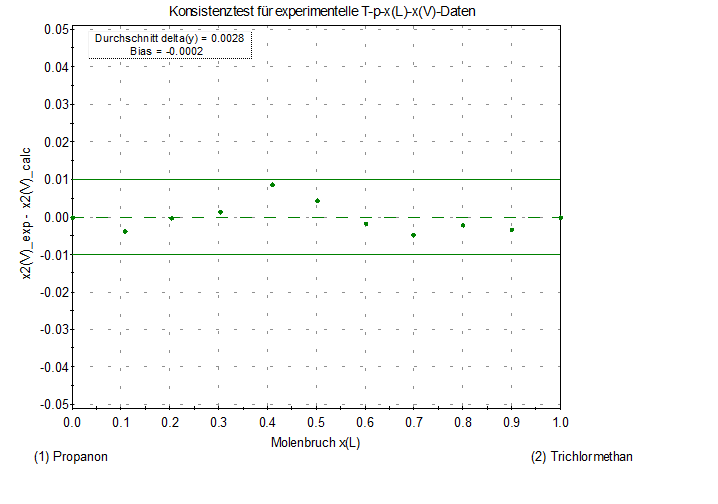
Qualitätsprüfung exper. VLE-Daten: Thermodynamischer Konsistenztest; Beispiel-Daten
guter Qualität
Thermodynamic
consistency test of experimental data; an example of data of good quality
|
|